嘉恒制药又获喜讯丨左乙拉西坦口服溶液新药注册证书到啦!
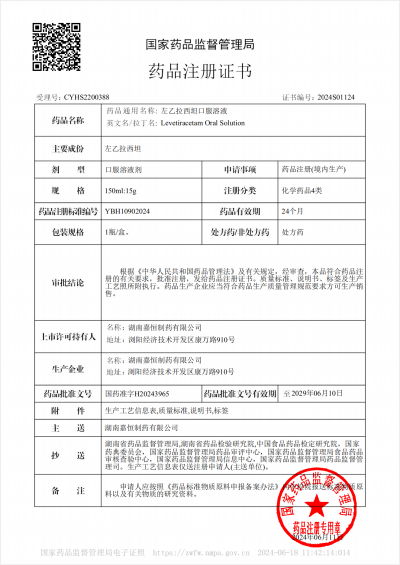
6月11日,嘉恒制药喜获左乙拉西坦口服溶液(150ml:15g)新药注册生产批文(视同通过“一致性评价”)。批准文号为“国药准字H20243965”。该产品将冠以嘉尔乐®商标。左乙拉西坦口服溶液是一种具有独特作用机制的新型有效的广谱抗癫痫药物,同时具有良好的抗癫痫疗效和安全性。左乙拉西坦是极易溶解和具有高度渗透性化合物,呈线性代谢,个体内和个体间差异小。国际上已广泛用于成人及儿童耐药性癫痫的添加治疗以及部分病人的单药治疗。我公司的左乙拉西坦口服溶液科学配制,组合包装,配有精准给药的适配器,能满足一个月以上婴幼儿、儿童及成人癫痫患者部分性发作的加用治疗。此次新获左乙拉西坦口服溶液注册批件,也是继公司2022年12月30日获得左乙拉西坦片剂注册批件之后,用于癫痫治疗的系列产品。重点填补了公司针对一个月以上婴幼儿、儿童癫痫治疗领域的用药空白。据世界卫生组织报告,全球约有5000万名癫痫患者。在我国,癫痫已经成为神经科仅次于头痛的第二大常见病。根据PDB数据库的资料显示,近年来抗癫痫药市场格局主要由4种药物占据,左乙拉西坦在抗癫痫药物中占比19.6%,排名第二。我国每年新发癫痫患者数量超40万人,抗癫痫药物国内市场广阔。未来,嘉恒制药将持续根据儿童用药制剂技术开发指导原则,实现儿童用药的可及性,确保实现精准给药。