“创新药一哥”大爆发 本月10款1类新药密集来袭
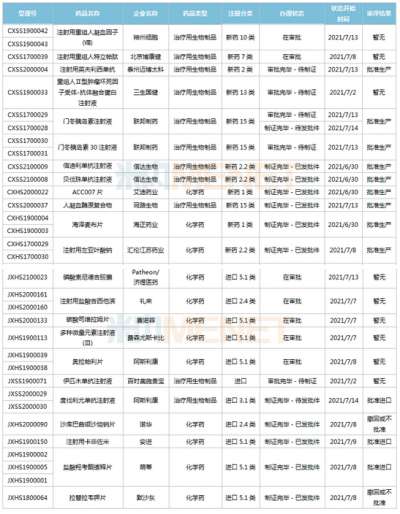
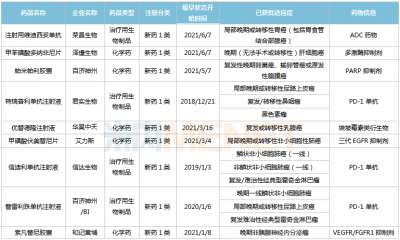
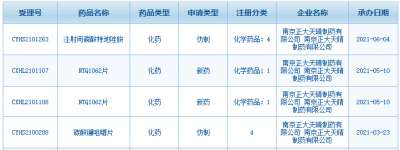
医药网8月19日讯 8月17日,山东盛迪医药1类新药HRS-8080片的临床申请获得CDE承办受理。米内网数据显示,2021年8月至今,恒瑞医药(含子公司)有13款创新药申报临床/上市(含新适应症等),其中10款为1类新药。 来源:CDE官网 作为“创新药一哥”,恒瑞医药在研发投入上一直处于领跑地位,2021年Q1研发费用13.16亿元,同比增长62.26%;研发费用占营收比重约19%,同比提升4.3%。 近3周(2021年8月至今),恒瑞医药共有13款创新药的上市/临床申请获得CDE承办受理,其中HRS-8080片、注射用SHR-A1921、HRS9531注射液、注射用SHR-A2009、HRS7415片为首次申报临床。 2021年8月至今恒瑞医药申报临床的新药 来源:米内网MED2.0中国药品审评数据库 非首次申报的新药中,甲磺酸阿帕替尼片、注射用卡瑞利珠单抗已有适应症获批上市;此外,多款新药最高研发进展已步入III期,SHR8554注射液是一款靶向μ受体(MOR)的小分子药物,术后疼痛的适应症正在开展II/III期临床;SHR0410注射液是一款选择性kappa受体激动剂,术后疼痛的适应症正在开展III期临床;苹果酸法米替尼胶囊是一款小分子多靶点酪氨酸激酶抑制剂,晚期胃肠间质瘤等适应症在开展III期临床;SHR-1701注射液是一款靶向PD-L1和TGFβ的双特异性抗体,晚期结直肠癌适应症正在开展II/III期临床。 从适应症看,抗肿瘤药是恒瑞医药主攻的治疗领域。米内网数据显示,2020年中国城市公立医院、县级公立医院、城市社区中心以及乡镇卫生院(简称中国公立医疗机构)及中国城市实体药店终端抗肿瘤药市场规模超过1000亿元。 中国城市实体药店终端抗肿瘤药销售情况(单位:万元) 来源:米内网中国城市实体药店终端竞争格局 对于新获批上市的创新药,零售药店是实现销售的主战场。得益于新药获批