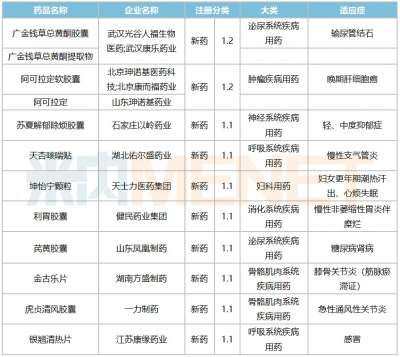
解郁除烦胶囊全国上市会隆重举行,1.1类创新药物更好惠及抑郁障碍患者
2022年6月30日,由中国神经科学学会精神病学基础与临床分会(CSNP)主办,中南大学湘雅二医院、上海交通大学医学院附属精神卫生中心、西安交通大学第一附属医院承办的“中国神经科学学会精神病学基础与临床分会第十九届全国学术年会”在千年古都陕西西安盛大召开。会上,“解忧除烦,向阳而生”—精神领域创新药全国上市会隆重举行,以岭药业携1.1类创新中成药解郁除烦胶囊精彩亮相。 本次全国上市会邀请到中华医学会精神病学分会主任委员、CSNP名誉主任委员李凌江教授,中华医学会精神病学分会副主任委员、CSNP主任委员王小平教授,中华医学会精神病学分会常务委员、西安交通大学第一附属医院副院长马现仓教授,中华医学会精神病学分会常务委员、昆明医科大学第一附属医院许秀峰教授,CSNP副主任委员、四川大学华西医院心理卫生中心主任李涛教授,CSNP副主任委员徐林教授等业内知名专家学者和来自全国的精神领域专家出席会议共同见证,李凌江教授担任会议主持。 李凌江教授在致辞中指出,抑郁障碍已经成为了不容忽视的、对人们身心健康产生严重影响的疾病,且抑郁症发病率已经逐年升高,其高复发率、高自杀率、低识别率、低就诊率的特点,越来越引起大众的关注。以岭药业作为国内中成药的龙头企业,在心血管、呼吸、内分泌、肿瘤等领域有着不错的成绩。此次国家1.1类创新中药解郁除烦胶囊的上市,也意味着以岭药业正式进军精神领域。他希望和期待解郁除烦胶囊能够给抑郁障碍患者带来福音,为社会公众健康贡献一份力量。 以岭药业新品市场部经理季凌霜代表以岭药业致辞。他表示,以岭药业自1992年成立以来,一直致力于科技创新、造福百姓。三十年来,企业以络病理论为指导,自主研发了通心络胶囊、连花清瘟胶囊、参松养